국내 개발 코로나19 치료제 임상 진입 지원

식품의약품안전처는 국내 개발사의 코로나19 치료제 개발을 임상시험계획 단계부터 적극적으로 지원하기 위해 임상시험계획 시 고려사항 등을 안내하는 ‘코로나19 치료제 임상시험계획서 정보집’을 31일 발간했다고 밝혔다.
정보집의 주요 내용은 ▲ 코로나19 치료제 작용기전 ▲ 국내외 코로나19 치료제 허가·임상시험 현황 ▲ 그간 임상시험 요약 정보 ▲ 임상 디자인, 대상자 범위 등 임상시험 설계 시 고려사항 ▲ 임상시험계획서 예시 등이다.
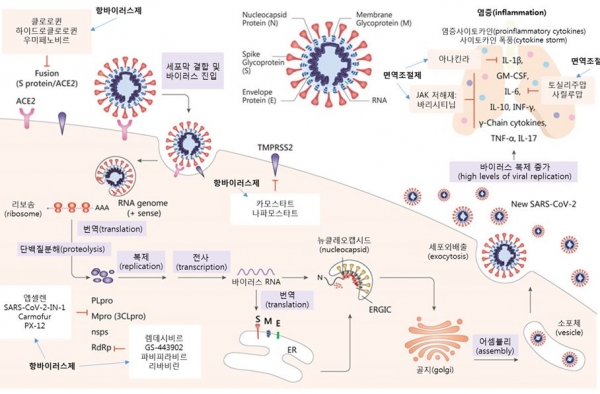
국내에서 임상시험계획을 승인받은 항바이러스제·면역조절제 코로나19 치료제는 4월 21일 기준 총 38건으로, 그중 항바이러스제 관련 임상시험이 31건, 항염증제 관련 임상시험이 6건, 면역증강제가 1건이다.
이번 정보집에서는 코로나19 치료제로 개발 중인 항바이러스제와 항염증제의 작용기전을 안내하고, 항바이러스제 2상 임상시험과 항염증제 3상 임상시험에 대한 임상시험계획서 예시를 수록했다.
임상시험계획서 예시에는 ▲ 치료기전별·단계별 임상시험 디자인 ▲ 시험대상자 선정·제외 기준 ▲ 안전성·유효성 평가변수 ▲ 투약 기간 ▲ 검사항목 ▲ 대상자 수 산출 근거 ▲ 통계분석 방법 등에 대해 안내돼 있다.
식약처는 이번에 발간된 정보집이 개발사의 임상시험계획 마련을 돕고 코로나19 치료제의 신속한 제품화에도 도움을 줄 수 있을 것으로 기대했다.
‘코로나19 치료제 임상시험계획서 정보집’은 식품의약품안전평가원 누리집(http://www.nifds.go.kr) > 정보마당 > 간행물·자료집에서 확인할 수 있다.
임춘호 기자
choonho@kbiz.or.kr


